این بررسی تا اینجا شواهد استفاده از واقعیت مجازی درمانی در جمعیتهای گوناگون بالینی را به عنوان ابزاری جدا یا ضمیمه مداخلات معمول توانبخشی عصبی مورد تفحص قرارداده است. با این یک سوال باقی میماند؛ آیا میتوان اثرات مثبت واقعیت مجازی را به تکنیکهای تعدیل عصبی مانند tDCS افزود، و یا آیا ممکن است ترکیب این فناوریها روش هدفمندتری برای پایش اثرات واقعیت مجازی بوسیله روشهای تصویربرداری مغزی غیرتهاجمی مانند fNIRS و EEG را فراهم کند؟
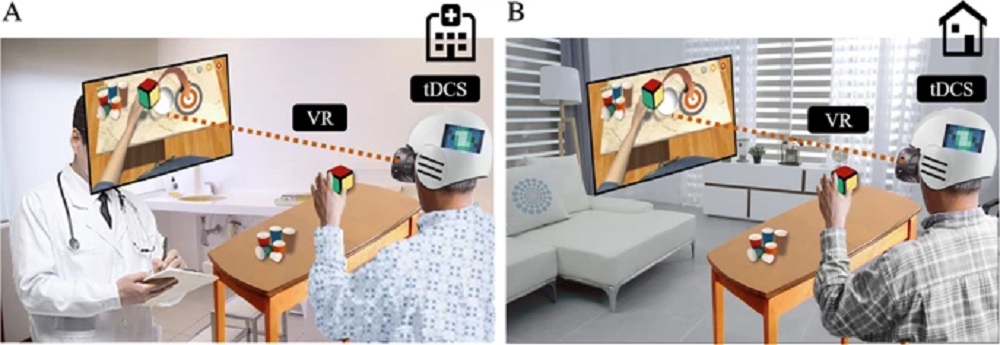
افزودن واقعیت مجازی درمانی به tDCS
تحریک فراجمجمهای جریان مستقیم روش نو ظهوری برای تحریک مغزی غیرتهاجمی است که از جریان الکرتیکی شدت پایین مستقیم برای تعدیل تحریکپذیری نورونهای غشری و شبکههای مرتبط با آنها استفاده میکند. بوسیله قرار دادن آند مثبت یا کاتد منفی بر روی پوست سر tDCS میتواند تحریکپذیری نورونهای قشری زیری را به شکل خاص قطبی تسهیل (tDCS آندی) و یا مهار (tDCS کاتدی) کند. به دلیل چنین اثر تعدیل عصبی قدرتمندی، tDCS معمولا به عنوان ضمیمه قبل (آفلاین) یا در طول (آنلاین) درمان توانبخشی برای بهبود عملکرد شناختی حرکتی در افراد سالم و یا جمعیت بالینی مورد استفاده قرار گرفته است.
در تئوری، استفاده از tDCS در کنار واقعیت مجازی درمانی برای افزوده شدن توانبخشی عصبی به نظر تکمیل کننده میرسد. بررسی که توسط لی و چان در سال 2014 انجام شد مشاهده کرد که پس از 15 جلسه واقعیت مجازی درمانی با tDCS کاتدی آنلاین بر روی قشر حرکتی آسیب ندیده بیماران سکته زیرآستانه شدید، جمعیت مورد بررسی نسبت به گروه شم بهبود در مقیاسهای بالینی خاص مربوط به سکته، تست عضله دستی و ایندکس بارتل را نشان دادند. سپس کیم و همکاران در سال 2014 نشان دادند که اضافه کردن tDCS آنلاین آندی بر روی قشر حرکتی آسیب ندیده در کنار واقعیت مجازی درمانی نه تنها کارکرد دست بالایی را بهبود بخشید، بلکه تحریک پذیری قشرینخاعی در بیماران سکتهای زیرآستانه شدید را افزایش داد.
در مقابل یافتههای اشاره شده، نتایج متناقضی توسط ویانا و همکاران در سال 2014 گزارش شد که اثرات ترکیب واقعیت مجازی با tDCS آفلاین آنودی بر روی قشر حرکتی بیماران سکتهای در طول 15 جلسه 1 ساعته واقعیت مجازی درمانی مقایسه کرد. در حالیکه نتایج هیچ تفاوت آماری در اندازهگیریهای بالینی مختص سکته (ارزیابی فاگل-میر، ارزیابی حرکتی ولف) در کارکرد بازوی بالایی بین بیمارانی که tDCS واقعی دریافت کرده بودند نسبت به گروه شم نیافت، باید به یاد داشت که بیش از 50% از بیمارانی که tDCS آنودی به همراه واقعیت مجازی درمانی دریافت کردند از لحاظ بالینی بهبودهای معناداری را در اسپاسم مچ دست پس از درمان نشان دادند. بر اساس این یافتههای محدود VR و tDCS، میتوان دید که اعمال tDCS در طول واقعیت مجازی درمانی فاکتوری معنادار در تقویت اثرات واقعیت مجازی درمانی به تنهایی است، که در ترکیب tDCS و توانبخشی عصبی نیز اینگونه است. گرچه ترکیب واقعیت مجازی و تعدیل عصبی (tDCS) بیشتر در اختلالات حرکتی اعمال شده است، با توجه به بهترین دانشمان میتوان گفت که هیچ بررسی شناخته شدهای در زمینه ترکیب این دو فناوری برای اختلالات شناختی و خلقی وجود ندارد. بنابراین درمانگرانی که از اکنون استفاده از واقعیت مجازی درمانی را در اختلالات روانی و خلقی اتخاذ کردهاند به شکل بالقوه میتوانند از استفاده همزمان VR و tDCS برای افزودن مزیتهای درمانی فراتر از واقعیت مجازی درمانی به تنهایی بیشترین استفاده را ببرند.
احتمال دارد که اثرات ترکیبی VR و tDCS تحت تاثیر ترکیب فاکتورهای گوناگونی باشد. برای مثال: 1) خصوصیتهای عمومی جمعیت (مثلا مناطق تحت تاثیر در مغز)؛ 2) پارامترهای tDCS مانند مکان قرارگیری الکترود (منطقه متاثر یا غیرمتاثر)، قطبیت (آنودی یا کاتدی)، زمانبندی اعمال tDCS (آنلاین یا آفلاین). در چنین مواقعی که تاثیرمداخلات ترکیبیVR و tDCS وابسته زمانبندی و مکان قرارگیری است (یعنی کی و کجا را تحریک کنیم)، روشی برای شناسایی و پایش تغییرات در کارکردهای نوروفیزیولوژیک در حین دریافت درمان توسط بیمار برای بهینه سازی اثرات مداخله حیاتی است. از این رو روشهای تصویربرداری عصبی میتوانند برای پایش پیشرفت درمان واقعیت مجازی مورد استفاده قرار بگیرند که در بخش بعدی خواهیم دید.
پایش واقعیت مجازی درمانی با تصویربرداری عصبی
تغییرات نوروفیزیولوژیک مرتبط با توانبخشی عصبی با استفاده از واقعیت مجازی را میتوان با روشهای غیرتهاجمی و پرتابل تصویربرداری عصبی مانند fNIRS و یا EEG اندازهگیری کرد تا تغییرات در واکنشهای همودیناکیک مغزی یا امواج مغزی نوسانی مشخص سازند. استفاده از fNIRS به خصوص به عنوان ابزاری برای اندازهگیری آنلاین واکنشهای همودینامیک مغزی در طول توانبخشی عصبی توجهها را به خود جلب کرده است (برای بررسیها مقالات ایرانی و همکاران در سال 2007 و یا فراری و کواریشما در سال 2012 را مطالعه کنید). استفاده از fNIRS به عنوان روش تصویربرداری عصبی متکی بر اصل جفت شدن عصبی-عروقی است که افزایش جریان خون منطقهای مغزی (دقیقا یعنی افزایش و کاهش در هموگلوبین اکسیژنه شده) را که توسط فعالسازی عصبی القا شده اندازهگیری میکند. میتوان این روش را با واکنشهای وابسته به سطح اکسیژناسیون خون اندازهگیری شده توسط fMRI قیاس کرد. اندازهگیری فعالسازی قشری بوسیله تکنیکهای fMRI و fNIRS نتایج شدیدا همبستهای را هم در تکالیف شناختی و هم در تکالیف حرکتی نشان میدهند. در حالیکه استفاده از تکنیکهای fNIRS در حال محبوبیت یافتن است، مدتها است از تکنیک EEG برای اندازهگیری تغییرات در امواج مغزی گوناگون (یعنی گاما، آلفا، بتا، تتا و دلتا) که هرکدام به شکلی متفاوت تحت تاثیر خلق، بیداری، بیماریهای نورولوژیک و آسیب مغزی قرار میگیرند استفاده شده است. هم fNIRS و هم EEG مزایای زیادی نسبت به fMRI دارند، قابل حمل هستند، استفاده از آنها نسبتا کم هزینه است و با دقت زمانی زیاد به راحتی قابل به کارگیری هستند. علاوه بر این نسل جدیدی از سیستمها اکنون با باتری عمل کرده، بیسیم هستند و به اندازه یک گوشی هوشمند کوچک شدهاند، برای اندازهگیریهای سرپایی و بدون اتصال مطابق با رویکردهای نوروارگونومیک ایدهآل هستند.
درحالیکه استفاده از تکنیکهای fNIRS و EEG در واقعیت مجازی درمانی نسبتا نوپا است، تا به امروز بیشتر بررسیها بر روی افراد سالم متمرکز بودهاند که نشاندهنده پتانسیل برای ظهور بررسیهای بیشتر در جمعیتهای بالینی با محبوبیت یافتن تکنولوژیهای تصویربرداری عصبی پرتابل است. استفاده حال حاضر از fNIRS و EEG در واقعیت مجازی دو نقش مطرح دارد: 1) بازخوردی از مناطق فعال شده مغزی در طول درمان را به شکل افزوده پایش و فراهم کند و 2) از fNIRS و EEG به عنوان بخشی از پارادایم رابط کاربری مغز ماشین برای درمان استفاده کند. در تایید نقش اول، تحقیقهای بسیاری اثر fNIRS و EEG برای ضبط تغییرات همودینامیکی و نوسانی در طول تکالیف واقعی حرکتی و تصویرسازی حرکتی در محیطهای واقعیت مجازی را مورد بررسی قرار دادهاند. این تحقیقات اثربخشی fNIRS و EEG برای شناسایی تغییرات مخصوص به تکلیف در الگوهای همودینامیکی و نوسانی را نشان دادهاند.
قابلیت fNIRS و EEG برای شناسایی تغییرات در اندازهگیریهای نوروفیزیولوژیک میتواند بازخوردی از محل و سطح فعالسازی را ارائه دهد خود میتواند توسط درمانگران و کاربران برای تعیین کردن شدت و پیشرفت درمان مورد استفاده قرار گیرد. علاوه بر این بازخورد فعالسازی قشری میتواند برای شناسایی مناطق بیش یا کم فعال مورد استفاده قرار بگیرد که خود این مناطق را میتوان بهوسیله تکنیکهای تعدیل عصبی از قبیل tDCS تعدیل کرد. در تایید نقش دوم، شناسایی مناطق فعالسازی قشری، الگوها و زمانبندی فعالسازی قشری با حرکات یا حالا روحی متنوعی مرتبط است که میتواند به عنوان کلاسبندی کننده برای تمرینات رابط کاربری مغز کامپیوتر به کار گرفته شود. به واقع، بیشتر تحقیقات رابط مغز کامپیوتر تا به امروز استفاده از EEG را به عنوان وسیله اندازهگیری فعالسازی قشری برای کنترل عضوی رباتیک یا یک آواتار در محیط واقعیت مجازی استفاده شده است. همچنین روشهای رابط مغز کامپیوتر برپایه fNIRS نیز ترکیب واقعیت مجازی و توانبخشی عصبی با تسهیل بیشتری امکانپذیر کردهاند. علاوه بر این استفاده همزمان از روشهای رابط کاربری مغز کامپیوتر بر پایه fNIRS و EEG نیز مورد بررسی قرار گرفتهاند. این مسئله پتانسیل استفاده از fNIRS را به روشی مشابه نشان میدهد که در آن واکنشهای همودینامیک قشری مرتبط را میتوان کلاسبندی کرد و از آن برای کنترل رباتیک یا رابط کاربری کامپیوتری استفاده کرد.
مجله: Frontiers in Human Neuroscience
https://www.frontiersin.org/articles/10.3389/fnhum.2017.00053/full